26 ottobre 2025 – Disbiosi intestinale, stress ossidativo e neuroinfiammazione sono spesso coesistenti nelle donne con endometriosi, contribuendo alla cronicizzazione del dolore e alla ridotta risposta ai trattamenti.
Questo articolo propone una strategia che combini nutraceutici a base di estratti vegetali con spiccate funzionalità antinfiammatorie e antiossidanti e probiotici ad azione specifica per agire a monte dei meccanismi disfunzionali, supportando la paziente in modo più completo e prolungato.
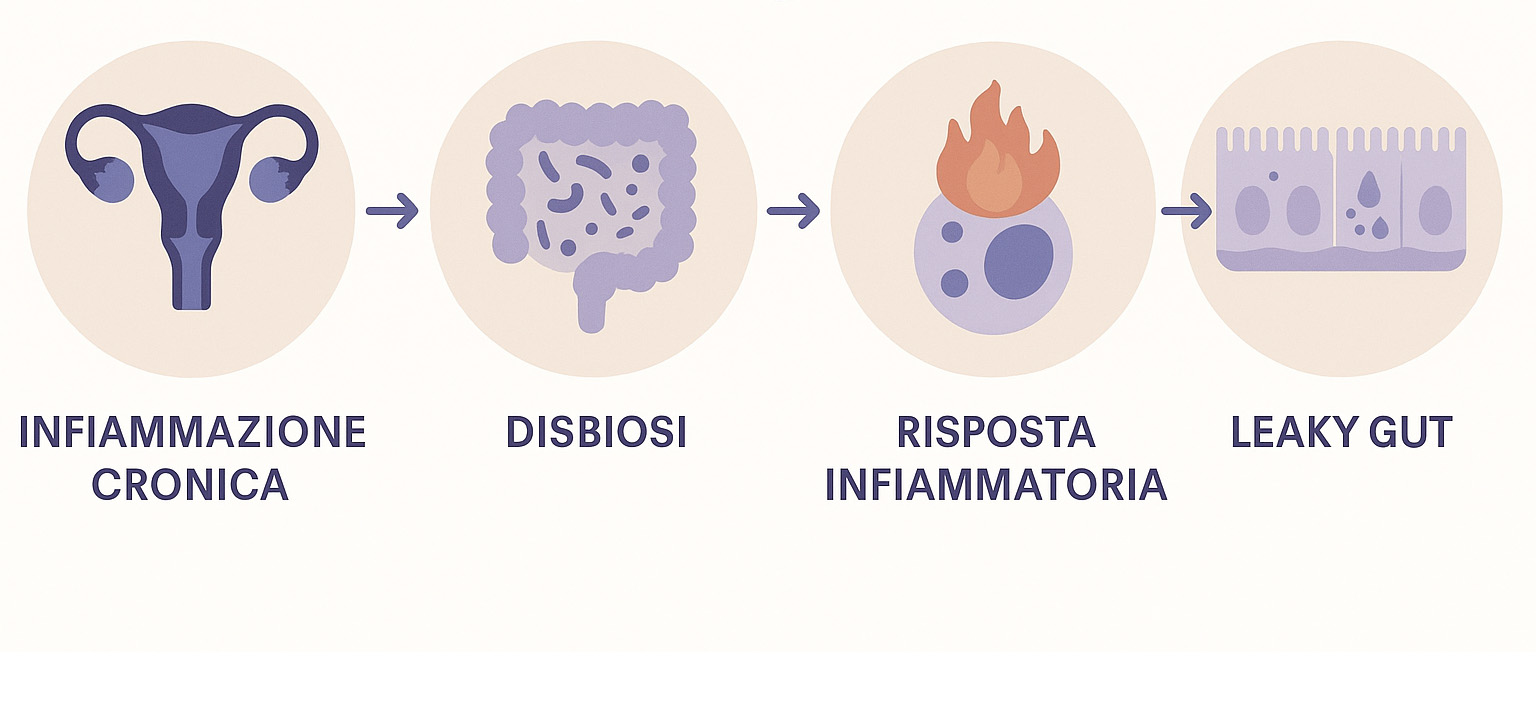
L’endometriosi è una patologia cronica e multifattoriale, caratterizzata da un’importante componente infiammatoria ed estrogeno-dipendente. Le donne che ne soffrono si trovano frequentemente ad affrontare un circolo vizioso di infiammazione cronica, stress ossidativo, neuroinfiammazione e disbiosi intestinale. Questi fattori contribuiscono in modo significativo al dolore persistente e alla ridotta efficacia delle terapie convenzionali. Rompere questo asse disfunzionale è cruciale per migliorare la qualità della vita delle pazienti.
Indice di navigazione
-
L’Asse Infiammazione-Disbiosi nell’Endometriosi: Un Legame Critico »
-
Gli Estratti Vegetali Contro Infiammazione e Ossidazione »
-
I probiotici ad Azione Specifica »
-
Conclusioni »
-
Bibliografia »
L’Asse infiammazione-disbiosi nell’endometriosi: Un legame critico
La correlazione tra infiammazione e disbiosi intestinale nell’endometriosi è un’area di ricerca sempre più approfondita. L’endometriosi è intrinsecamente legata a uno stato di infiammazione cronica sia sistemica che locale, alimentata da un’attivazione anomala del sistema immunitario e dalla produzione di citochine pro-infiammatorie come il TNF-α, l’IL-6 e l’IL-1 beta [7].
Contemporaneamente, molte donne con endometriosi presentano disbiosi intestinale, ovvero uno squilibrio nella composizione e nella funzione del microbiota intestinale. Questo squilibrio può portare a un aumento della permeabilità intestinale, comunemente definita “leaky gut”. Tale aumento permette a componenti batterici (come il lipopolisaccaride – LPS) e a metaboliti tossici di passare dal lume intestinale al circolo sanguigno. Questo passaggio attiva le cellule immunitarie e amplifica la risposta infiammatoria sistemica, creando un circolo vizioso che esacerba la patologia endometriosica [8].
Diversi studi clinici e test In Vitro hanno dimostrato la correlazione disbiosi-endometriosi:
- Evidenza di disbiosi nel microbiota intestinale: Alcuni studi clinici hanno rivelato alterazioni significative del microbioma nelle pazienti endometriosiche, per esempio con una diminuzione di batteri benefici (es. Lactobacillus, Bifidobacterium) e un aumento di specie potenzialmente pro-infiammatorie come Escherichia coli, Streptococcus, Proteobacteria ed Enterobacteriaceae [9, 10, 15, 16]. Queste alterazioni sono state correlate con la gravità dei sintomi e del dolore pelvico. L’alterazione dell’estroboloma (i batteri intestinali che metabolizzano gli estrogeni) può inoltre portare a un aumento dei livelli circolanti di estrogeni liberi, favorendo la crescita del tessuto endometriosico, dato che l’endometriosi è una malattia estrogeno-dipendente [17].
- Evidenza di disbiosi nel microbiota del tratto riproduttivo: Non solo l’intestino, ma anche il microbiota del tratto riproduttivo (vaginale, cervicale, fluido peritoneale e endometriale) mostra alterazioni nelle donne con endometriosi, con una ridotta presenza di Lactobacillus e una maggiore prevalenza di batteri patogeni [16, 18, 26].
- Permeabilità intestinale (“Leaky Gut”): Un aumento della permeabilità intestinale è stato riscontrato in donne con endometriosi [11], probabilmente a causa dall’esposizione a fattori infiammatori tipici dell’endometriosi che compromette l’integrità delle giunzioni strette tra le cellule epiteliali intestinali, con conseguente passaggio di sostanze pro-infiammatorie nel circolo sistemico [12].
- Impatto bidirezionale dell’infiammazione e della disbiosi: L’infiammazione cronica associata all’endometriosi non solo è aggravata dalla disbiosi, ma può anche influire negativamente sulla salute intestinale stessa. Le citochine pro-infiammatorie possono alterare la motilità intestinale, la sensibilità viscerale e la composizione del muco intestinale, creando un ambiente favorevole alla disbiosi [7].
Gli estratti vegetali contro infiammazione e ossidazione
In questo scenario, la natura offre potenti alleati. Prezzemolo, sedano e rosmarino, erbe aromatiche comuni nella dieta mediterranea, si distinguono per le loro notevoli proprietà antinfiammatorie e antiossidanti e possono costituire dei nuovi importanti alleati nel contrastare l’endometriosi:
- Prezzemolo (Petroselinum crispum): Ricco di flavonoidi (come apigenina e luteolina), che vantano spiccate proprietà antinfiammatorie e antiossidanti, e apiolo. L’apigenina, in particolare, è stata studiata per la sua capacità di modulare le vie infiammatorie. Ricerche precliniche e test in vitro hanno mostrato che l’apigenina inibisce la proliferazione, l’invasione e la migrazione delle cellule endometriali, suggerendo un potenziale nel rallentare la progressione della malattia [1, 2]. Mentre l’apiolo modula la risposta infiammatoria, mediante inibizione della cascata infiammatoria e riduzione della produzione di citochine pro-infiammatorie, e svolge un’attività antiossidante grazie alla sua struttura fenolica [19, 20].
- Sedano (Apium graveolens): Similmente al prezzemolo, il sedano è una fonte eccellente di flavonoidi. Test in vitro e studi su animali suggeriscono che anche altri composti fenolici del sedano possono contribuire a ridurre lo stress ossidativo e l’infiammazione [4]. Contiene inoltre polisaccaridi che possono agire come prebiotici, nutrendo i batteri benefici nell’intestino e supportando l’equilibrio del microbiota [3]. Questa azione prebiotica contribuisce a contrastare la disbiosi intestinale.
- Rosmarino (Rosmarinus officinalis): Ricco di acido rosmarinico e carnosico, potenti antiossidanti e antinfiammatori. L’acido rosmarinico ha dimostrato di inibire diverse vie infiammatorie e di proteggere le cellule dallo stress ossidativo [5]. Le sue proprietà antimicrobiche possono anche contribuire a modulare la flora intestinale, contrastando la crescita di batteri patogeni e favorendo un ambiente più sano [6].
I probiotici ad azione specifica
La correlazione tra la disbiosi intestinale e l’azione di specifici ceppi probiotici, come Lactiplantibacillus plantarum LP09 e Lacticaseibacillus rhamnosus LR06, è di grande rilevanza per la gestione dell’endometriosi. Questi ceppi sono ampiamente studiati per la loro capacità di modulare il microbiota intestinale e di conferire benefici alla salute, inclusa la risoluzione della disbiosi stessa:
- Lactiplantibacillus plantarum (ex Lactobacillus plantarum): Le specie di plantarum sono note per la loro capacità di favorire l’eubiosi, aumentando l’abbondanza di batteri che producono metaboliti benefici come gli acidi grassi a catena corta (SCFA), cruciali per la salute dell’epitelio intestinale e la regolazione immunitaria [21]. Inoltre, Lactiplantibacillus plantarum P09 ha dimostrato di ridurre la gravità della diarrea cronica in uno studio clinico controllato con placebo, indicando un ripristino dell’equilibrio microbico e della funzione della barriera intestinale [23].
- Lacticaseibacillus rhamnosus (ex Lactobacillus rhamnosus): Questo probiotico è ben noto per la sua resistenza e la capacità di adesione alle cellule epiteliali. È ampiamente utilizzato per la prevenzione e il trattamento di vari tipi di diarrea, inclusa quella associata agli antibiotici [23]. Il ceppo LR06 rientra tra le specie che hanno mostrato effetti benefici sulla salute del tratto urogenitale, contribuendo a ristabilire l’equilibrio del microbiota e a contrastare la crescita eccessiva di batteri disbiotici [24]. Studi su altri ceppi di rhamnosus hanno evidenziato la loro capacità di modulare l’immunità e ridurre l’infiammazione [25].
L’utilizzo combinato di questi due ceppi contribuisce a ripristinare un microbiota intestinale più equilibrato, riducendo le specie pro-infiammatorie e aumentando quelle benefiche, e consente di spezzare il circolo vizioso tra disbiosi e infiammazione sistemica nell’endometriosi mediante:
- Modulazione della risposta immunitaria e produzione di citochine infiammatorie
- Riduzione della permeabilità intestinale, limitando il passaggio di tossine e LPS che alimentano l’infiammazione.
- Modulazione dell’Estroboloma, contribuendo a un migliore metabolismo degli estrogeni e potenzialmente riducendo l’eccesso di estrogeni circolanti che può alimentare la crescita delle lesioni endometriosiche [17].
Conclusioni
Considerando la crescente evidenza del ruolo della disbiosi nell’endometriosi, un approccio integrato che combini nutraceutici con forti proprietà antinfiammatorie e antiossidanti e probiotici ad azione specifica potrebbe offrire un supporto significativo alle donne che convivono con questa condizione.
In tal senso, prezzemolo, sedano e rosmarino insieme a Lactiplantibacillus plantarum e Lacticaseibacillus rhamnosus potrebbero costituire la combinazione base, da arricchire con ulteriori sostanze (ad esempio, vitamina D, curcumina, resveratrolo, acido α-lipoico, omega-3) in funzione delle specificità delle pazienti endometriosiche da trattare.
Bibliografia
- Salehi, B., et al. (2019). “Apigenin: A Review of Its Beneficial Effects and Its Molecular Mechanisms.” Applied Sciences, 9(12), 2686.
- Jo, M., et al. (2015). “Apigenin inhibits the proliferation and invasion of endometriosis cells via suppression of PI3K/Akt/mTOR signaling pathway.” Journal of Ethnopharmacology, 172, 1-8.
- Kooti, W., et al. (2016). “Phytochemistry, Pharmacology, and Therapeutic Uses of Celery (Apium graveolens).” Journal of Complementary and Integrative Medicine, 13(4), 317-327.
- Kim, M. J., et al. (2014). “Antioxidant and anti-inflammatory activities of Apium graveolens (celery) extracts.” Journal of Food Science and Nutrition, 19(2), 154-159.
- Prieto, M. A., et al. (2015). “Biological Activities of Rosmarinic Acid: A Review.” Molecules, 20(9), 17094-17112.
- Loizzo, M. R., et al. (2008). “In vitro antimicrobial and antioxidant activities of the essential oils and extracts of Rosmarinus officinalis and Salvia officinalis L.” Journal of Pharmacy and Pharmacology, 60(11), 1699-1707.
- Laschke, M. W., & Menger, M. D. (2016). “The gut microbiota and endometriosis.” Gynecological Endocrinology, 32(9), 678-683.
- Leonardi, M., et al. (2020). “Endometriosis and the Gut Microbiota: A Systematic Review.” Journal of Clinical Medicine, 9(12), 3740.
- Ata, B., et al. (2019). “The Endometrial Microbiome in Endometriosis: A Systematic Review.” Reproductive Sciences, 26(3), 329-338.
- Svensson, A., et al. (2021). “The Gut Microbiota in Women with Endometriosis: A Pilot Study.” Journal of Clinical Medicine, 10(12), 2736.
- Sajadian, M., et al. (2022). “Increased Intestinal Permeability in Women with Endometriosis: A Case-Control Study.” Journal of Obstetrics and Gynaecology Canada, 44(4), 450-456.
- Camilleri, M. (2019). “Leaky gut: mechanisms, measurement and clinical implications.” Clinical Gastroenterology and Hepatology, 17(7), 1243-1250.
- Koga, Y., et al. (2020). “Effect of Lactobacillus gasseri OLL2809 on the pain of endometriosis: a randomized, double-blind, placebo-controlled trial.” Gynecological Endocrinology, 36(6), 543-547.
- Liu, X., et al. (2023). “Celery soluble dietary fiber antagonizes flavonoids ameliorative effect on dextran-sodium-sulfate-induced colitis in mice.” Food and Chemical Toxicology, 181, 114092.
- Zhu J, et al. (2024). “Comparison of microbial abundance and diversity in uterine and peritoneal fluid in infertile patients with or without endometriosis”. BMC Women’s Health. 2024 Feb 29;24(1):148.
- Koninckx, P. R., et al. (2021). “The microbiome and endometriosis: an update.” Fertility and Sterility, 115(2), 281-285.
- Kwa, M., et al. (2016). “The intestinal microbiome and estrogen metabolism.” Journal of Steroid Biochemistry and Molecular Biology, 164, 182-188.
- Wang, Y., et al. (2021). “The vaginal and gut microbiota in women with endometriosis: A systematic review and meta-analysis.” Journal of Assisted Reproduction and Genetics, 38(11), 2977-2989.
- Nordeen SK, Bona BJ, Mok SC, Carney ME. Apigenin suppresses estrogen receptor alpha expression in human breast cancer cells. Horm Cancer. 2013;4(5):293–300.
- Zhang H, Yang X, Zhang J, Guo Y. Evaluation of antioxidant activity of parsley essential oil and its protective effect on lipid peroxidation. Food Res Int. 2006;39(8):833–9.
- Salehi, B., et al. (2019). “Apigenin: A Review of Its Beneficial Effects and Its Molecular Mechanisms.” Applied Sciences, 9(12), 2686.
- Li, X., et al. (2024). “Lactiplantibacillus plantarum P9 for chronic diarrhea in young adults: a large double-blind, randomized, placebo-controlled trial.” Journal of Clinical Gastroenterology.
- WebMD (https://www.webmd.com/). “Lacticaseibacillus Rhamnosus: Overview, Uses, Side Effects, Precautions, Interactions, Dosing and Reviews.”
- Kim, D. Y., et al. (2023). “Characterization of the probiotic properties of Lacticaseibacillus rhamnosus LR6 isolated from the vaginas of healthy Korean women against vaginal pathogens.” Frontiers in Cellular and Infection Microbiology, 13, 10720895.
- Li, H., et al. (2024). “Study on the effect and mechanism of Lacticaseibacillus rhamnosus AFY06 on inflammation-associated colorectal cancer induced by AOM/DSS in mice.” Frontiers in Microbiology, 15, 1382781.
- gov Identifier: NCT05824819. “Endometriosis and Peritoneal Dysbiosis.” (Current trial recruiting). Jagiellonian University. Recruiting (accessed October 2025) – studio clinico in corso.